北京隆福佳生物科技有限公司代理商
8 年
手机商铺
商家活跃:
产品热度:
- NaN
- 0
- 1
- 0
- 3
代理商
北京隆福佳生物科技有限公司
入驻年限:8 年
- 联系人:
纪小姐
- 所在地区:
北京 石景山区
- 业务范围:
技术服务、实验室仪器 / 设备、细胞库 / 细胞培养、试剂、ELISA 试剂盒、抗体、耗材、论文服务、医疗器械
- 经营模式:
经销商 代理商
推荐产品
公司新闻/正文
低氧/厌氧产品案例——低氧与心梗研究
260 人阅读发布时间:2022-03-14 11:50
文章题目:Extracellular vesicles from human embryonic stem cell-derived cardiovascular progenitor cells promote cardiac infarct healing through reducing cardiomyocyte death and promoting angiogenesis
人胚胎干细胞来源的心血管祖细胞的细胞外囊泡通过减少心肌细胞死亡和促进血管生成来促进心肌梗死的愈合
人胚胎干细胞来源的心血管祖细胞的细胞外囊泡通过减少心肌细胞死亡和促进血管生成来促进心肌梗死的愈合
文章出处:Cell Death Dis, 2020, 11: 354. 中国科学院组织微环境与肿瘤重点实验室,分子心脏病实验室
工作站使用情况:Ruskinn Hypoxic workstation
使用气体浓度:低氧(1% O2,<0.1%)
摘要:人类多能干细胞(hPSCs)衍生的心血管祖细胞(CVPCs)是心肌修复的一种有前途的来源,但其机制仍在很大程度上未知。细胞外囊泡(ev)已知介导细胞-细胞通讯,然而,在心肌梗死(MI)急性期给予hPSC - CVPC 分泌的EV(hCVPC- EV 在梗死愈合中的作用和机制尚不清楚。本实验研究了在梗死心脏常氧(EV-N)和低氧(EV-H)条件下hESC-CVPCs 分泌的EV 的心脏保护作用和长链非编码RNA (lncRNA)相关机制。研究发现,急性心肌梗死小鼠心肌注射hCVPC- EV 可显著改善心肌功能,减少心肌纤维化,改善边缘区血管化和心肌细胞存活。同时,hCVPC- EV 增强了人脐静脉内皮细胞(HUVECs)的导管形成和迁移,提高了细胞活力,并减弱了氧葡萄糖剥夺(OGD)损伤的新生大鼠心肌细胞(NRCMs)的乳酸脱氢酶释放。EV-H 对HUVECs 心肌细胞存活和管形成的改善明显优于EV-N。RNA-seq 分析显示在EV-H 中存在大量的lncRNA MALAT1。在经hCVPC - EV 处理的梗死心肌和心肌细胞中,其丰度上调。过表达人MALAT1 可改善OGD 损伤的NRCM 细胞活力,而敲低MALAT1 可抑制hCVPC - EV 促进的HUVECs 管的形成。此外,研究表明,MALAT1 通过靶向miR-497 改善了NRCMs 的生存和HUVEC 管的形成。这些结果说明,hCVPC - EV 通过改善心肌细胞存活和血管生成促进梗死愈合。hCVPC- EV 的心脏保护作用可以通过hCVPC 的缺氧调节而增强,并部分由MALAT1 通过靶向miRNA 发挥作用。
工作站使用情况:Ruskinn Hypoxic workstation
使用气体浓度:低氧(1% O2,<0.1%)
摘要:人类多能干细胞(hPSCs)衍生的心血管祖细胞(CVPCs)是心肌修复的一种有前途的来源,但其机制仍在很大程度上未知。细胞外囊泡(ev)已知介导细胞-细胞通讯,然而,在心肌梗死(MI)急性期给予hPSC - CVPC 分泌的EV(hCVPC- EV 在梗死愈合中的作用和机制尚不清楚。本实验研究了在梗死心脏常氧(EV-N)和低氧(EV-H)条件下hESC-CVPCs 分泌的EV 的心脏保护作用和长链非编码RNA (lncRNA)相关机制。研究发现,急性心肌梗死小鼠心肌注射hCVPC- EV 可显著改善心肌功能,减少心肌纤维化,改善边缘区血管化和心肌细胞存活。同时,hCVPC- EV 增强了人脐静脉内皮细胞(HUVECs)的导管形成和迁移,提高了细胞活力,并减弱了氧葡萄糖剥夺(OGD)损伤的新生大鼠心肌细胞(NRCMs)的乳酸脱氢酶释放。EV-H 对HUVECs 心肌细胞存活和管形成的改善明显优于EV-N。RNA-seq 分析显示在EV-H 中存在大量的lncRNA MALAT1。在经hCVPC - EV 处理的梗死心肌和心肌细胞中,其丰度上调。过表达人MALAT1 可改善OGD 损伤的NRCM 细胞活力,而敲低MALAT1 可抑制hCVPC - EV 促进的HUVECs 管的形成。此外,研究表明,MALAT1 通过靶向miR-497 改善了NRCMs 的生存和HUVEC 管的形成。这些结果说明,hCVPC - EV 通过改善心肌细胞存活和血管生成促进梗死愈合。hCVPC- EV 的心脏保护作用可以通过hCVPC 的缺氧调节而增强,并部分由MALAT1 通过靶向miRNA 发挥作用。
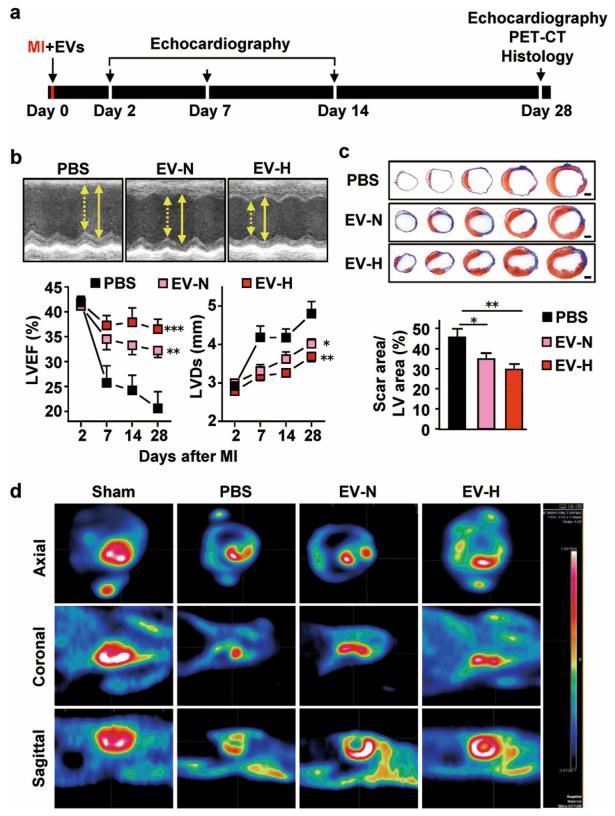
Fig. 2 Cardioprotective effects of hCVPC-EVs delivered to acutely infarcted murine hearts by permanent ligation of the LAD coronary artery. a Schematic of treatment and analysis using hCVPC-extracellular vesicles. b Echocardiographic analysis of LVEF and LVDs. n = 8 (PBS), 8 (EV-N), and 11 (EV-H). c Representative cross-sectional images and quantitative data of hearts stained with Masson’s trichrome at day 28 post MI. n = 6–8. Scale bars, 1 mm. d In vivo PET/CT images at day 28 post MI. *p < 0.05, **p < 0.01, ***p < 0.001.
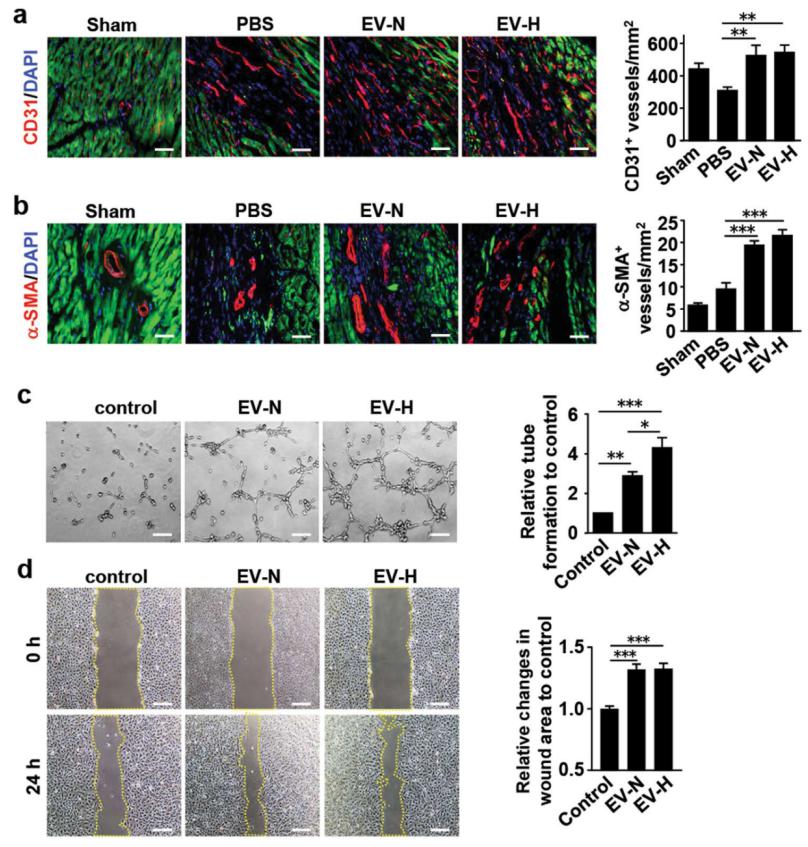
Fig. 4 Effects of hCVPC-EVs on HUVECs migration, tube formation and NRCMs protection. a, b Representative and quantification of immunohistochemical (IHC) staining for CD31+ endothelial cells (a) and α-SMA+ blood vessels (b) in the border zone of infarcted hearts at day 28 post MI. n = 12 slices from 4 hearts each group. c Tube formation of HUVECs treated with EV-N and EV-H (n = 6). d Migration of HUVECs treated with the EV-N and the EV-H after inhibition of proliferation with 10 μg /mL mitomycin for 2 h (n = 5). Scale bar, 100 μm. *p < 0.05, **p < 0.01, ***p < 0.001.
为了评估hCVPC-EVs 在小鼠心肌梗死模型的急性期给药时的治疗效果,在常氧(EV-N)和低氧(EVH)培养条件下hCVPC-EVs 在患有心肌梗死的小鼠中进行心肌内注射;研究表明hCVPC-EV 在增强心功能和限制纤维化形成方面具有心脏保护作用,而低氧培养的hCVPCs-EV 对改善梗死心脏的功能有更好的益处(图2);
血管新生有助于减少梗死心脏的细胞死亡和纤维化;免疫组织化学分析显示,MI 后28 天,EV-N和EV-H 组心肌边缘区CD31+血管(图4a)和α-SMA+血管(图4b)数量显著增加;hCVPC-EV-N 或hCVPC-EV-H 处理后的HUVECs 管长明显增加,且hCVPC-EV-H 处理效果优于hCVPC-EV-N 处理(图4C);hCVPC-EV 处理也促进了HUVEC 的迁移(图4d)。揭示hCVPC-EV 可促进血管生成,而低氧培养的hCVPC-EV 效果更明显。
为了评估hCVPC-EVs 在小鼠心肌梗死模型的急性期给药时的治疗效果,在常氧(EV-N)和低氧(EVH)培养条件下hCVPC-EVs 在患有心肌梗死的小鼠中进行心肌内注射;研究表明hCVPC-EV 在增强心功能和限制纤维化形成方面具有心脏保护作用,而低氧培养的hCVPCs-EV 对改善梗死心脏的功能有更好的益处(图2);
血管新生有助于减少梗死心脏的细胞死亡和纤维化;免疫组织化学分析显示,MI 后28 天,EV-N和EV-H 组心肌边缘区CD31+血管(图4a)和α-SMA+血管(图4b)数量显著增加;hCVPC-EV-N 或hCVPC-EV-H 处理后的HUVECs 管长明显增加,且hCVPC-EV-H 处理效果优于hCVPC-EV-N 处理(图4C);hCVPC-EV 处理也促进了HUVEC 的迁移(图4d)。揭示hCVPC-EV 可促进血管生成,而低氧培养的hCVPC-EV 效果更明显。






